Lo zinco è un elemento chimico che non si trova libero in natura, ma è abbastanza diffuso nei suoi minerali quali:
- la blenda (o sfalerite, come solfuro di zinco)
- la calamina (o emimorfite, come silicato idrato)
- la smithsonite (come carbonato)
- la zincite (come ossido di zinco), più rara
- la franklinite (come ferrite)
- la willemite (come silicato)
L’estrazione dello zinco avviene principalmente utilizzando i minerali di sfalerite e smithsonite.
E’ un metallo bianco-grigio-azzurro, duttile e malleabile. All’aria, a freddo, si ricopre di uno strato superficiale di carbonato basico che lo protegge da una più profonda alterazione e lo rende resistente ad un ulteriore attacco degli agenti atmosferici.
Per l’accrescimento di molti organismi animali e vegetali lo zinco è un elemento essenziale. Tracce di zinco sono presenti nell’insulina.
IN CHIMICA
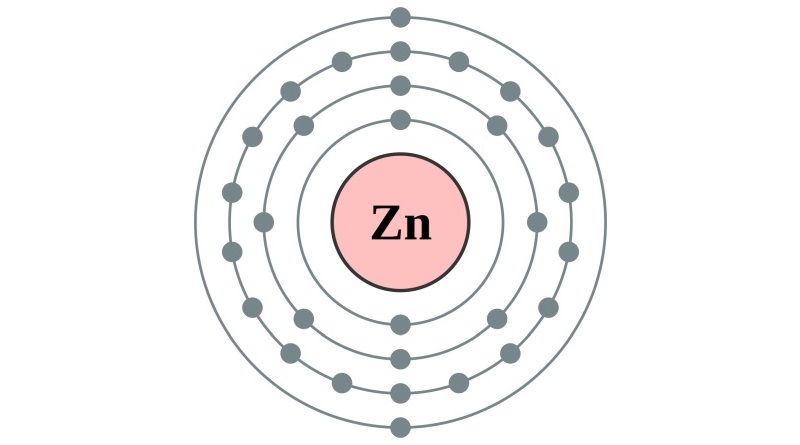
Nome elemento: zinco
Simbolo: Zn
Sistema periodico (gruppo-periodo-blocco): 12-4-d
Numero atomico: 30
Massa atomica relativa (uma): 65,37
Isotopi: tredici, dei quali cinque stabili (64,66,67,68 e 70)
Punto di fusione: 419,5 °C
Punto di ebollizione: 907 °C
Densità (peso specifico): 7,14 Kg/dm3
Riscaldato intorno ai 900 °C brucia con fiamma luminosa formando leggeri fiocchi bianchi di ossido (lana filosofica); reagisce con gli acidi minerali, specie solforico e cloridrico diluiti, liberando ossigeno.
CENNI STORICI
I minerali di zinco furono usati fin dall’antichità per preparare gli ottoni. Lo zinco divenne noto in Europa nel Medioevo, ma era già conosciuto da molto tempo in Asia. Sembra che Paracelso, nel XVI secolo, sia sia stato il primo europeo che abbia riconosciuto lo zinco come elemento metallico che chiamò zinckum. Il metallo puro fu però ottenuto solo verso la metà del ‘700 da Marggraf, trattando la calamina con carbone.
PREPARAZIONE E APPLICAZIONI
Lo zinco viene usato per rivestire altri metalli che protegge galvanicamente dalla corrosione. Si prepara riducendo con carbone il suo ossido, ottenuto per per arrostimento dei minerali in forni speciali; questo metallo, impuro per presenza di piombo, arsenico e cadmio, viene lisciviato con acido solforico e sottoposto ad elettrolisi, che dà zinco puro al 99,8%. Il metodo, non molto dispendioso, viene usato su vasta scala.
Lo zinco forma diversi composti, tra i quali si ricordano:
- l’ossido, polvere bianca che si ottiene bruciando i vapori di zinco distillato in storte e si impiega come pigmento (bianco di zinco) nell’industria della gomma sintetica, per pomate medicinali e in cosmetica come astringente e disinfettante.
- il cloruro si ottiene sciogliendo il metallo in acido cloridrico; solubilissimo in acqua, è fortemente disidratante; si impiega nei laboratori chimici come catalizzatore, nella lavorazione della lana e nell’industria dei coloranti.
- il solfuro si trova in natura come blenda e come wurtzite; mescolato al solfato di bario, si utilizza come pigmento bianco con il nome di litopone e presenta elevato potere coprente. In presenza di tracce di metalli pesanti il solfuro, convenzionalmente seccato, è fosforescente ed era adoperato come luminescente, sotto il nome di blenda di Sidot, negli schermi televisivi, oscilloscopi, apparecchi per raggi X.
- il solfato, che si prepara sciogliendo il metallo in acido solforico diluito, si adopera per la zincatura elettrolitica dei metalli, come mordente in tintoria, per la stampa dei tessuti e soprattutto nei bagni di coagulazione del raion viscosa.
Lo zinco viene impiegato principalmente come rivestimento protettivo di altri metalli, per fabbricare lastre resistenti agli agenti atmosferici, come riducente in molte reazioni chimiche, per la zincatura del ferro, per preparare leghe come argentana e ottoni, in tipografia per incisioni su lastre di zinco (zincotipia).
IN ECONOMIA
Lo zinco è il XXIII elemento più abbondante nella crosta terrestre. In tonnellate prodotte, si trova al IV posto nella produzione globale tra tutti i metalli – superato solo da ferro, alluminio e rame. Circa tre quarti dello zinco utilizzato è consumato come metallo, principalmente come rivestimento per proteggere il ferro e l’acciaio dalla corrosione (ferro/acciaio zincato), come componente di lega per fabbricare bronzo e ottone, come lega di pressofusione a base di zinco e come laminato. Il restante quarto è consumato come composto, principalmente nell’industria della gomma, chimica, delle vernici ed agricola.
PRODUZIONE
Il paese nel quale si estrae lo zinco in maggiore quantità è la Cina; a notevole distanza seguono Perù, Australia, Stati Uniti, Canada e India. Di seguito la produzione mondiale di zinco negli ultimi 60 anni.
| anno | mln ton. |
| 1950 | 2,150 |
| 1955 | 2,900 |
| 1960 | 3,090 |
| 1965 | 4,310 |
| 1970 | 5,460 |
| 1975 | 5,850 |
| 1980 | 5,950 |
| 1985 | 6,760 |
| 1990 | 7,150 |
| 1995 | 7,280 |
| 2000 | 8,770 |
| 2001 | 8,910 |
| 2002 | 8,880 |
| 2003 | 9,520 |
| 2004 | 9,600 |
| 2005 | 10,000 |
| 2006 | 10,300 |
| 2007 | 11,100 |
| 2008 | 11,900 |
| 2009 | 11,600 |
| 2010 | 12,300 |
| 2011 | 12,500 |
| 2012 | 12,900 |
| 2013 | 13,100 |
| 2014 | 13,300 |
PREZZI
La posizione della Cina nel periodo 1991-2006 è mutata; è passata da buon consumatore al principale consumatore di zinco al mondo.
Nel corso del 2001 negli Stati Uniti c’è stata una flessione generalizzata dell’economia e un calo del 20% nelle vendite di automobili. Questi eventi hanno colpito l’industria dell’acciaio, dove circa il 60% dello zinco statunitense viene utilizzato per fabbricare prodotti zincati.
I consumi ridotti negli Stati Uniti hanno contribuito ad un aumento dell’offerta, con il conseguente crollo dei prezzi.
Di seguito l’andamento dei prezzi dello zinco negli ultimi 60 anni.
| anno | USD/ton |
| 1950 | 306 |
| 1955 | 271 |
| 1960 | 286 |
| 1965 | 320 |
| 1970 | 338 |
| 1975 | 859 |
| 1980 | 825 |
| 1985 | 890 |
| 1990 | 1.640 |
| 1995 | 1.230 |
| 2000 | 1.230 |
| 2001 | 969 |
| 2002 | 852 |
| 2003 | 896 |
| 2004 | 1.160 |
| 2005 | 1.480 |
| 2006 | 3.500 |
| 2007 | 3.400 |
| 2008 | 1.960 |
| 2009 | 1.720 |
| 2010 | 2.250 |
| 2011 | 2.340 |
| 2012 | 2.110 |
| 2013 | 2.110 |
| 2014 | 2.360 |